Capter les bons signaux au cœur des cellules pour mieux traiter les cancers
Luba Tchertanov est directrice de recherche CNRS au Centre Borelli (CNRS/ENS Paris-Saclay) et responsable de l’équipe Bioinformatique, Modélisation et Dynamique Moléculaire (BiMoDyM). À l'interface des mathématiques, de l'informatique, de la physique et de la biologie, ses travaux décrivent finement et en 3D ce qui se passe au sein des cellules. Ils contribuent notamment à mieux comprendre les processus anormaux menant à des cancers, mais aussi les résistances à certains de leurs traitements.
Avec son équipe, Luba Tchertanov étudie les propriétés et l’activité de certaines protéines du corps humain, que ce soit dans leur fonctionnement normal ou leurs dysfonctionnements qui peuvent mener à des pathologies graves comme des cancers. En décortiquant les processus cellulaires jusqu’au niveau atomique et en les modélisant sous forme 3D numérique, ses travaux dévoilent les anomalies associées à ces maladies. Ils permettent aussi de mieux comprendre les résistances à certains traitements et d’identifier des cibles inédites pour le développement de nouveaux médicaments. Des enjeux majeurs de la recherche actuelle : « En complément des observations cliniques et empiriques, les simulations de la dynamique des protéines et l'exploration des données par des méthodes avancées donnent accès à des modèles complexes essentiels à la recherche en biologie d’aujourd’hui », déclare Luba Tchertanov.
Une recherche interdisciplinaire pour mieux comprendre les processus anormaux liés aux cancers
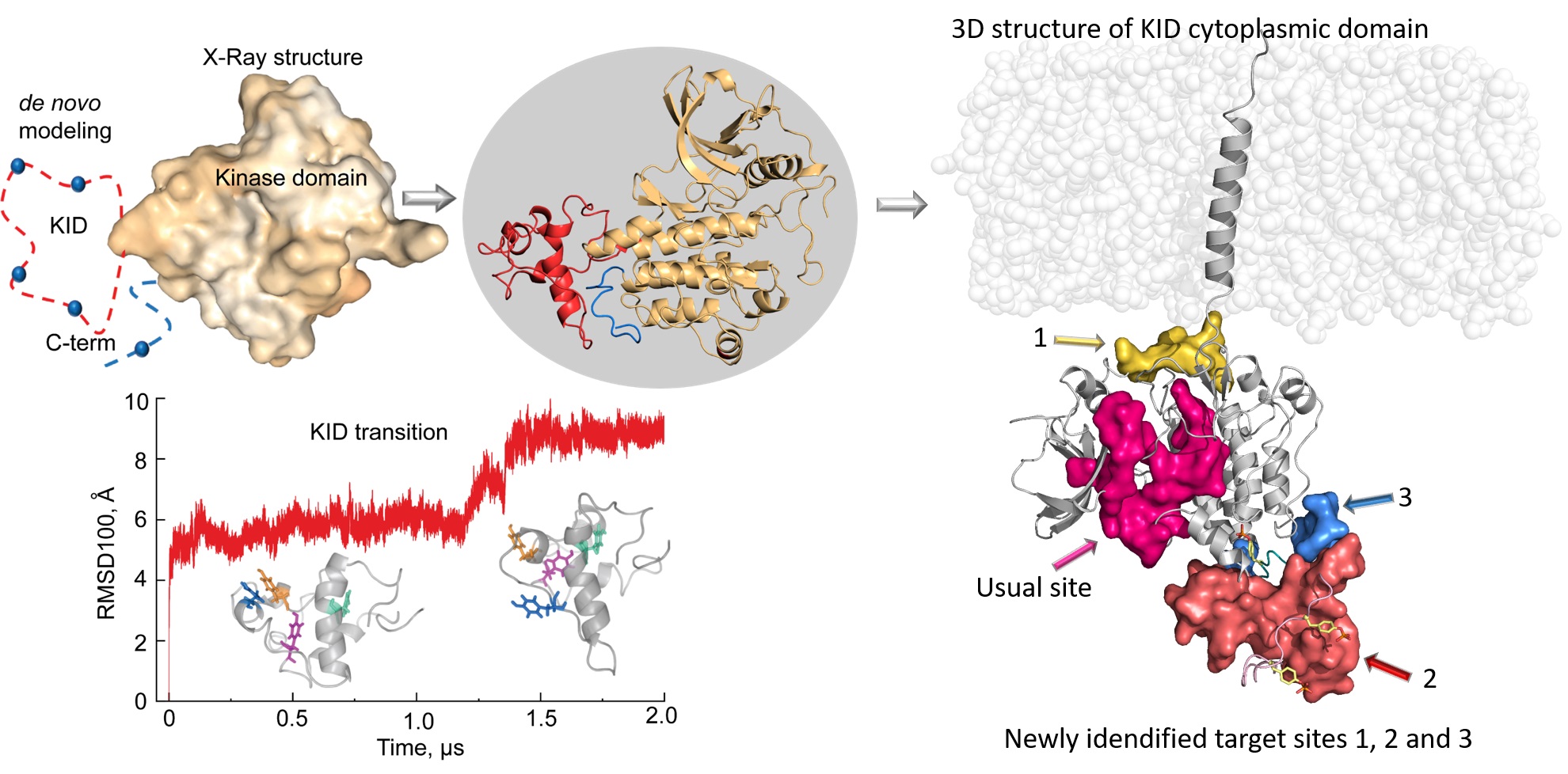
Luba Tchertanov exerce ses fonctions de directrice de recherche au Centre Borelli, dont l’ « activité porte sur l'ensemble des applications des mathématiques, des neurosciences et de la recherche biomédicale, ce qui correspond parfaitement à [mon] axe de recherche interdisciplinaire ». Après avoir travaillé sur des virus dont le VIH, la chercheuse a été sensibilisée à la problématique des cancers sanguins lorsqu’un de ses jeunes collègues en a été tragiquement victime et que Gustave Roussy, hôpital situé à Villejuif et figurant parmi les meilleurs hôpitaux au monde en cancérologie, s’est intéressé à ses travaux. Elle s’est en particulier consacrée aux récepteurs à activité tyrosines kinase, une famille de protéines impliquées dans les processus physiologiques de transfert d’un signal extérieur vers l’intérieur des cellules, mais aussi dans le développement de maladies comme les leucémies. Des médicaments inhibiteurs des récepteurs de tyrosine kinase (ITKs) sont déjà prescrits pour traiter ces cancers, mais bien qu’efficaces, leurs effets indésirables sont importants et des résistances peuvent apparaître, compliquant les traitements.
Des alternatives pour des traitements plus ciblés, plus efficaces et mieux tolérés
Dès 2009, Luba Tchertanov a participé au projet innovant APAS-IPK (Amélioration de la Productivité de l’Activité et de la Sélectivité des Inhibiteurs de Protéines Kinases en Oncologie) sur le volet modélisation moléculaire, lui permettant de mener une recherche tournée vers la pharmacologie. Ses travaux ont donné lieu à plus de 20 articles de revues et de conférences et à des avancées scientifiques majeures, en particulier grâce à une meilleure connaissance du rôle des mutations sur la structure et la dynamique des récepteurs à tyrosine kinase et une meilleure connaissance des mécanismes des mécanismes de résistance aux ITKs associés à ces récepteurs mutés. « Les ITKs actuels inhibent le site d’activation des récepteurs à tyrosine kinase, explique Luba Tchertanov. Mais ces récepteurs possèdent un site quasi similaire et d’autres protéines non réceptrices exercent la même activité kinase. Les ITKs s’attaquent donc à des protéines ‘innocentes’ en perturbant leurs processus physiologiques, ce qui peut engendrer de sévères effets secondaires. » La scientifique explore donc des cibles alternatives plus spécifiques au récepteur à tyrosine kinase visé, notamment en agissant sur certaines des étapes successives de la transmission du signal dans la cellule jusqu’à son noyau. « Élaborer des cibles à l’interface des protéines ouvre des perspectives intéressantes pour minimiser les résistances et les effets secondaires de ces anticancéreux », conclut Luba Tchertanov.